Polyphenol – hợp chất trao đổi thứ cấp ở thực vật có nhiều chức năng sinh học quý
Các hợp chất polyphenol là một nhóm hợp chất trao đổi thứ cấp ở thực vật, rất phổ biến trong tự nhiên với hơn 10.000 hợp chất được xác định cấu trúc tính đến nay (Kennedy and Wightman, 2011). Chúng có đặc điểm cấu tạo chung là chứa vòng thơm gắn với một hoặc nhiều nhóm hydroxyl, có thể ở trạng thái tự do, ester hóa hoặc gắn với các đường bằng liên kết glycosid (Bravo, 1998; Manach et al., 2004). Polyphenol được coi là chất chống oxy hóa tự nhiên dồi dào trong chế độ ăn uống của con người (Mudgal et al., 2010) bởi lẽ chúng đóng góp tới 90% tổng khả năng chống oxy hóa trong hầu hết các loại rau và quả.
Các hợp chất polyphenol rất đa dạng về cấu trúc và chức năng. Tùy thuộc vào mạch carbon mà chúng được phân loại thành phenolic acid, flavonoid, stilbene, lignin và tannin (Hình 1). Cấu trúc cuả các hợp chất polyphenol quyết định cơ chế và mức độ hoạt động sinh học của chúng.
    |
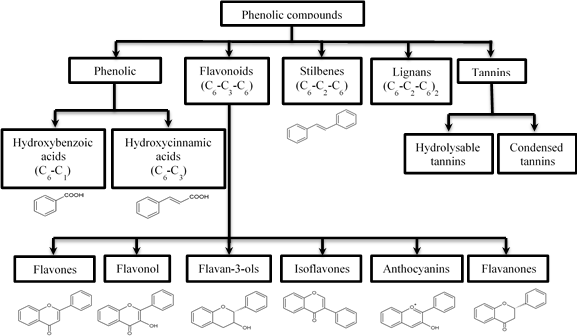 |
| Hình 1. Phân loại các hợp chất polyphenol (Han et al., 2007) |
Ở thực vật, các hợp chất polyphenol tạo màu cho thực vật (anthocyanin); bảo vệ thực vật trước tia cực tím chống lại sự oxi hóa; là hợp chất tín hiệu cho sự cộng sinh giữa thực vật và vi khuẩn nốt sần; bảo vệ thực vật khỏi sự tấn công của vi sinh vật gây hại (như vi khuẩn gây thối rễ ở khoai tây); là vật liệu góp phần vào độ bền chắc của thực vật và sự thấm của thành tế bào đối với nước và không khí (Chirinos et al., 2007). Đối với thực phẩm, polyphenol quyết định hương vị của nhiều sản phẩm có nguồn gốc từ thực vật. Ở mức độ nhất định chúng tham gia vào các quá trình tạo ra các cấu tử hương mới, tạo nên các hình thơm đặc biệt cho sản phẩm (Lê Ngọc Tú, 2003). Đối với con người, polyphenol ngăn chặn nhiều bệnh mãn tính như bệnh tim mạch, ung thư, bệnh đái tháo đường, viêm khớp và bệnh thoái hóa thần kinh nhờ các đặc tính sinh học quý của chúng bao gồm chống oxy hóa, chống viêm, chống ung thư và kháng khuẩn (Cicerale et al., 2012; Kukreja et al., 2014).
Tác dụng của việc chiếu tia UVB đến sinh tổng hợp polyphenol ở thực vật
Bức xạ cực tím (UV) của ánh sáng Mặt trời được chia thành UV-A (320-400 nm), UV-B (280-320 nm) và UV-C (dưới 280 nm) trong đó ước tính 90-95% tia UVA và 5-10% tia UVB chiếu được xuống Trái đất còn tia UVC thì không vượt qua được lớp khí quyển.
Việc tiếp xúc với tia UVB cảm ứng sự sinh tổng hợp và tích lũy các hợp chất polyphenol trong thực vật bởi lẽ các hợp chất này đóng vai trò như các chất lọc ánh sáng, hạn chế tác hại của stress oxi hóa gây nên bởi tia cực tím. Anthocynin (polyphenol tạo màu đỏ, tím, xanh, đen cho thực vật) được tăng cường sinh tổng hợp trong ngô, gạo, táo, hoa hồng khi chiếu tia UVB (Guo et al., 2008). Quả việt quất được chiếu tia UVB trước thu hoạch ở các liều lượng khác có hàm lượng anthocyanin cao hơn quả không được chiếu 148-167% (Li et al., 2021). Hàm lượng một số flavonol như quercetin glycoside và kaempferol-3-rhamnoside trong lá cây bạch dương bạc, xúp lơ xanh, đậu xanh tăng khi lá được chiếu tia UVB (Tegelberg et al., 2001; Kuhlman and Muller, 2009; Choydhary and Agrawal; 2014). Ở dâu tây, bên cạnh flavonol, quercetin và kaempferol, hàm lượng anthocyanin của quả tăng khi cây được chiếu tia UVB trong quá trình phát triển. Hàm lượng một số polyphenol khác như caffeic acid, p-coumaric acid và ferulic acid trong cà chua tăng lên 20% so với mẫu đối chứng khi cà chua được chiếu tia UVB (Luthria et al., 2006). Coumarin và furanocumarin cũng được tích lũy mạnh trong lá cây mùi tây khi cây này được chiếu UVB (Zangerl and Berenbaum, 1987). Các hợp chất này được tích lũy tại lớp biểu bì của các tế bào tiếp xúc với tia UVB, có tác dụng như tấm lọc ánh sáng có hại, bảo vệ các mô bên trong của rau quả (Takshak and Agrawal, 2016).
Tác dụng của việc chiếu tia UVB đến tích lũy polyphenol ở rau quả sau thu hoạch
Chiếu tia UV-B gây ra sự tích tụ của anthocyanin và làm tăng khả năng chống oxy hóa của rau quả sau thu hoạch. Su et al. (2015) báo cáo ảnh hưởng của chiếu xạ UV-B ở liều 5 W/m2 đến sinh tổng hợp anthocyanin trong mầm củ cải và cho thấy anthocyanin bắt đầu tích lũy nhanh chóng từ 24 giờ sau chiếu xạ và tăng liên tục cho đến 48 giờ, đạt nồng độ anthocyanin cao hơn hai lần so với đối chứng (không xử lý). Trong quả nho đen, việc chiếu tia UVB với liều trung bình là 8,2 Ws/m2 kích thích sự tổng hợp anthocyanin trong thời gian ngắn (Huyskens-Keil, 2007). Trong nghiên cứu của Nguyen et al. (2014), quả việt quất được tiếp xúc với tia UVB ở liều 6 kJ/m2 và sau đó bảo quản ở 0°C trong 28 ngày. Trong quá trình bảo quản, hàm lượng polyphenol tổng số và khả năng kháng oxy hóa của quả việt quất xử lý bằng tia UV-B luôn cao hơn so với đối chứng. Bên cạnh đó, hàm lượng các anthocyanin riêng lẻ tăng lên rõ rệt trong 3 giờ sau khi xử lý. Ở giai đoạn chuyển màu (độ chín S6), hàm lượng anthocyanin của quả việt quất chiếu xạ UV-B (liều 2.76 kJ/ m2 trong thời gian 10 phút) tăng lên 61% so với đối chứng (Yang et al., 2018). Huyskens-Keil et al. (2007) báo cáo rằng xử lý UV-B trong thời gian 60 và 120 phút (8.2 Ws/m2 ở khoảng cách 30 cm đến quả) thúc đẩy tổng hợp anthocyanin, flavonol, hydroxycinnamic acid và hydroxybenzoic acid trong quả nho đen. Khả năng kháng oxi hóa tăng đáng kể (21%) bởi bức xạ UV-B sau 120 phút tiếp xúc.
Các gen và enyme tham gia quá trình sinh tổng hợp polyphenol được cảm ứng bởi việc chiếu tia UVB
Việc tăng hàm lượng các hợp chất polyphenol khi chiếu tia cực tím được giải thích một phần do tác động của việc xử lý UV-B lên sự biểu hiện của một số gen mã hóa các enzym trong con đường phenylpropanonid, là con đường sinh tổng hợp các polyphenol trong thực vật. Một số gen được cảm ứng biểu hiện bởi chiếu xạ UVB được tổng hợp và giới thiệu ở Hình 2. Chúng bao gồm phenylalanin amoniac lyase, chalcone synthase, stilbene synthase, chalcone isomerase, flavanone-3-hydroxylase, dihydroflavonol-4-reductase, anthocyanidin synthase, leucoanthocyanidin reductase và UDP-Glc-flavonoid 3-O-glucosyl transferase (enzyme xúc tác gắn đường vào nhân anthocyanidin) (Vogt, 2010; Su et al., 2015; Yang et al., 2018).
    |
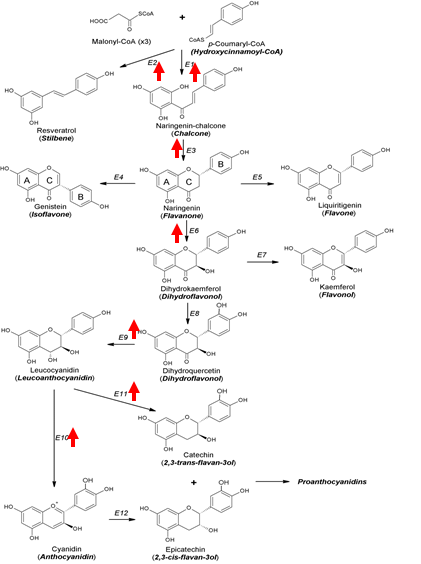 |
| Hình 2. Con đường phenylpropanoid với các gen mã hóa cho các enzyme được cảm ứng biểu hiện bởi chiếu xạ UVB (mũi tên màu đỏ) (Tổng hợp từ Su và cộng sự, 2014; Vogt, 2010; Yang và cộng sự, 2018). Enzymes: (E1) Chalcone synthase; (E2) Stilbene synthase; (E3) Chalcone isomerase; (E4) Isoflavone synthase; (E5) Flavone synthase; (E6) Flavanone 3-hydroxylase; (E7) Flavonol synthase; (E8) Flavonoid 3’-hydroxylase; (E9) Dihydroflavonol 4-reductase; (E10) Anthocyanidin synthase; (E11) Leucoanthocyanidin reductase; (E12) Anthocyanidin reductase. |
Việc nghiên cứu ứng dụng chiếu tia UVB trong tăng cường sinh tổng hợp các hợp chất tự nhiên có hoạt tính sinh học đã được thực hiện tại Khoa Công nghệ thực phẩm, Học viện Nông nghiệp Việt Nam. Kết quả bước đầu cho thấy, việc chiếu tia UVB làm tăng hàm lượng anthocyanin, polyphenol tổng số và khả năng kháng oxi hóa ở quả sim (Rhodomyrtus tomentosa) và quả trâm (Syzygium cumini) lên 10-25% so với quả đối chứng không chiếu. Nghiên cứu tiếp tục được thực hiện trên một số đối tượng rau, quả khác và dược liệu nhằm mục đích ứng dụng kỹ thuật kỹ thuật chiếu tia UVB trong xử lý sau thu hoạch, tăng cường giá trị sinh học của rau, quả và dược liệu.
Tài liệu tham khảo
1. Bravo L. (1998). Polyphenols: Chemistry, dietary sources, metabolism, and nutritional significance. Nutrition Reviews, 56(11): 317-333.
2. Chirinos, R., Campos, D., Arbizu, C., Rogez, H., Rees, J-F., Larondelle, Y., Noratto, G., Cisneros-Zevallos, L. (2007). Effect of genotype, maturity stage and postharvest storage on phenolic compounds, carotenoid content and antioxidant capacity, of Andean mashua tubers (Tropaeolum tuberosum Ruiz & Pavãn). Journal of the Science of Food and Agricultural, 87: 437-446.
3. Cicerale S., L. J. Lucas, & R. S. J. Keast (2012). Antimicrobial, antioxidant and anti-inflammatory phenolic activities in extra virgin olive oil. Current Opinion in Biotechnology, 23: 129-135.
4. Choudhary K. K., Agrawal S. B. (2014). Cultivar specificity of tropical mung bean (Vigna radiata L.) to elevated ultraviolet-B: Changes in antioxidative defense system, nitrogen metabolism and accumulation of jasmonic and salicylic acids. Environmental and Experimental Botany, 99: 122-132.
5. Guo J., Han W., Wang M., (2008). Ultraviolet and environmental stresses involved in the induction and regulation of anthocyanin biosynthesis: A review. African Journal of Biotechnology, 7: 4966-4972.
6. Han X., T. Shen, & H. Lou (2007). Dietary polyphenols and their biological significance. International Journal of Molecular Sciences, 8(9): 950-988.
7. Huyskens-Keil, S., Eichholz, I., Kroh, L.W. and Rohn, S. (2007). UV-B induced changes of phenol composition and antioxidant activity in black currant fruit
(Ribes nigrum L.). Journal of Applied Botany and Food Quality, 81: 140-144.
8. Kennedy D. O. and E. L. Wightman (2011). Herbal extracts and phytochemicals: plant secondary metabolites and the enhancement of human brain function. Advances in Nutrition, 2(1): 32-50.
9. Kuhlmann F. and Müller C. (2009). Independent responses to ultraviolet radiation and herbivore attack in broccoli. Journal of Experimental Botany, 60: 3467-3475.
10. Kukreja, A., Wadhwa, N. and Tiwari, A. (2014) Therapeutic role of resveratrol and piceatannol in disease prevention. Journal of blood disorders & transfusion 5: 240. doi:10.4172/2155-9864.1000240
11. Lê Ngọc Tú (2003). Hóa học thực phẩm. NXB Khoa học và Kỹ thuật, p.221-291.
12. Li T., Yamane H. and Tao R. (2021). Preharvest long-term exposure to UV-B radiation promotes fruit ripening and modifies stage-specific anthocyanin metabolism in highbush blueberry. Horticulture Research, 8, 67, 12 pages
13. Luthria D. L., Mukhopadhyay S., Krizek D. T. (2006). Content of total phenolics and phenolic acids in tomato (Lycopersicon esculentum Mill.) fruits as influenced by cultivar and solar UV radiation. Journal of Food Composition and Analysis, 19: 771-777.
14. Manach C., A. Scalbert, C. Morand, C. Rémésy, & L. Jiménez (2004). Polyphenols: food sources and bioavailability. The American Journal of Clinical Nutrition, 79: 727-747.
15. Mudgal V., N. Madaan, A. Mudgal, & S. Mishra (2010). Dietary polyphenols and human health. Asian Journal of Biochemistry, 5(3): 154-162.
16. Su, N., Lu, Y., Wu, Q., Liu, Y., Xia, Y., Xia, K., & Cui J. (2015). UV-B-induced anthocyanin accumulation in hypocotyls of radish sprouts continues in the dark after irradiation. Journal of Agricultural and Food Chemistry, 96(3): 886-892
17. Takshak S. and Agrawal S. B. (2016). Ultraviolet-B radiation: a potent elicitor of phenylpropanoid pathway compounds. Journal of Scientific Research, 60: 79-96.
18. Tegelberg R., Julkunen-Tiitto R., Aphalo P. J. (2001). The effects of long-term elevated UV-B on the growth and phenolics of field-grown silver birch (Betula pendula). Global Change Biology, 7: 839-848.
19. Tsao R. (2010). Chemistry and biochemistry of dietary polyphenols. Nutrients, 2: 1231-1246.
20. Nguyen C.T. T., Kim J., Yoo K. S., Lim S., and Lee E. J. (2014). Effect of Prestorage UV-A, -B, and -C Radiation on Fruit Quality and Anthocyanin of ‘Duke’ Blueberries during Cold Storage. Journal of agricultural and food chemistry, 62, 12144−12151.
21. Yang J., Li B., Shi W., Gong Z., Chen L., and Hou Z. (2018). Transcriptional Activation of Anthocyanin Biosynthesis in Developing Fruit of
Blueberries (Vaccinium corymbosum L.) by Preharvest and Postharvest UV
Irradiation. DOI: 10.1021/acs.jafc.8b03081.
22. Vogt, T. (2010). Phenylpropanoid Biosynthesis. Molecular Plant, 3(1), 2-20.
Lại Thị Ngọc Hà, Khoa Công nghệ thực phẩm